




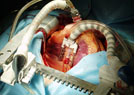





В названном номере газеты опубликована статья о внедрении «челябинскими кардиологами нового метода лечения ишемической болезни сердца», заключающегося во введении в организм больного так называемых «фетальных тканей». Не касаясь этических вопросов, возникающих при получении данных тканей (последние можно получить в процессе абортов) и послуживших основой для запрета их использования в ряде стран с развитой медициной, мы хотели бы охарактеризовать данный, в большинстве случаев пока экспериментальный, метод терапии с профессиональных позиций. Хотя авторы публикации называют внедряемую методику «трансплантацией фетальных тканей», имеется более общепринятое название для данных методов – клеточная трансплантация. Клеточная трансплантация широко изучается многими лабораториями мира [1-8,10]. Сущностью применяемых субстанций для клеточной трансплантации, с которой первоначально гипотетически связывался биологический эффект, является так называемая стволовая клетка, «прародитель» всех существующих в организме человека клеток и тканей. На способности стволовой клетки превращаться в любую специфическую ткань и основываются смысл идеи клеточной трансплантации и надежды на возможную ее высокую лечебную эффективность. Естественно, в кардиологии специфической тканью, на восстановление которой направлены все разработки по клеточной трансплантации, является ткань миокарда – кардиомиоциты и капиллярные сосуды, питающие их.
Анализируя предлагаемый «метод лечения ишемической болезни сердца», целесообразно выделить его компоненты в виде вопросов с последующим ответом на них на основе опубликованных в международной литературе данных и сравнении последних с оригинальной челябинской методикой:
1. Каков клеточный и биологический состав вводимых авторами метода «фетальных» тканей?
2. Каковым был способ введения данных тканей в организм пациентов-волонтеров?
3. При каком заболевании вводились «фетальные» ткани и оценивалась эффективность их использования?
4. На основании каких критериев произведена оценка положительного результата введения «фетальных» тканей при данном заболевании?
Авторы публикации характеризуют вводимые субстанции следующим образом: «Фетальные ткани – это ткани плода, находящиеся (?) на малом сроке развития. Они содержат большое количество клеток (их называют полипотентными), которые могут превращаться в различные клетки организма – сердца, центральной нервной системы, мышцы, соединительной ткани».
Из данного описания следует, что, вероятнее всего, полученная в процессе аборта плодная ткань использовалась в виде суспензии всех имеющихся фетальных клеток. В зарубежных странах полипотентная клетка выделяется не из плодных тканей, а из тканей костного мозга, ауто- или аллогенного происхождения [1]. Кроме того, для клеточной трансплантации с целью замещения погибших клеток миокарда используются аутомиобласты (предшественники миоцитов) скелетных мышц, строго говоря, не являющиеся стволовыми клетками [1,2,3]. Вместе с тем, при выделении клеточного материала из костного мозга человека возникает много вопросов. К примеру, до конца не выявлен оптимальный тип стволовых клеток костного мозга, наиболее приемлемый для клеточной трансплантации: мононуклеарные клетки, мезенхимальные стволовые клетки или предшественники гемопоэза. В целом, установлено, что клетки костного мозга стимулируют формирование кровеносных сосудов в миокарде, т.е. ангиогенез, но механизм этой стимуляции оказался связанным не с превращением введенных стволовых клеток в клетки эндотелиального фенотипа, а с наличием в клеточной субстанции ангиогенез — стимулирующих факторов. Также нет данных о дифференциации введенных стволовых клеток в фенотип кардиомиоцита. Улучшение же функции инфарцированного миокарда экспериментальных животных после трансплантации клеток костного мозга происходит, вероятно, лишь вследствие активизации неоангиогенеза, в связи с чем используется термин биошунтирование (по аналогии с аорто-коронарным шунтированием) [3].
Экспериментальные данные относительно миобластов более конкретны. Они трансформируются в зрелые мышечные клетки, оставаясь скелетными, т.е. без какого-либо изменения по направлению к кардиомиогенному роду клеток, при одновременном улучшении функции миокарда [1]. Вероятно поэтому имплантация скелетных миобластов названа клеточной кардиомиопластикой по аналогии с динамической кардиомиопластикой [8].
Следует подчеркнуть, что в лабораториях, занимающихся так называемым тканевым инженерингом, т.е. созданием тканей для трансплантации, пока не удалось заставить стволовую клетку превратиться в кардиомиоцит или, к примеру, гепатоцит. Для выращивания этих тканей выделяют бластные дифференцированные клетки сердца или печени. На настоящий момент полипотентная клетка in vitro демонстрирует дифференциацию в клетки тканей, близких к соединительной: костной и хрящевой [8].
Таким образом, механизм действия введенных клеток не совпадает с гипотетическими представлениями о полипотентной стволовой клетке, «спешащей» заменить любую поврежденную ткань пациента или лабораторного животного.
Используемая авторами «нового метода» клеточная субстанция столь не однородна, что разобраться в механизме ее действия, а в случае какой-либо эффективности лечения – связать эту эффективность с трансформацией стволовой клетки в кардиомиоцит или эндотелиальную клетку, по меньшей мере, наивно. Тем не менее, поскольку установлена возможность применения клеток костного мозга для стимуляции неоангиогенеза у лабораторных животных с острым миокардиальным инфарктом или устойчивой к лечению ишемии, нельзя исключить и возможность подобного «биошунтирующего» действия «фетальных тканей», но возникает вопрос о способе их доставки к поврежденному участку сердца.
Касаясь методики введения фетальных тканей авторами «нового метода», можно с уверенностью полагать, что оригинальная субстанция вводилась одним из парентеральных методов, более вероятно внутривенным. Вместе с тем, следует упомянуть тот факт, что ключевым моментом в проведении любой трансплантационной процедуры является доставка прививаемого материала к объекту замещения. Исключением из этого правила может являться лишь трансплантация костного мозга в гематологической практике, проводимая простым неселективным введением трансплантируемых тканей. Но в этом случае следует помнить о вездесущности ретикуло-эндотелиальной системы и о том, что трансплантационная процедура направлена на замещение всеобщего медиума организма – крови. Иная ситуация имеется при попытках лечения клеточной трансплантацией некроза или сниженной сократительной способности миокарда. Единственным способом введения прививаемого материала в этом случае, будь то один из типов стволовых клеток костного мозга, скелетные миобласты или фетальные клетки, является введение его интрамиокардиально, т.е. напрямую в миокард путем пункции зоны повреждения со стороны эпикарда / эндокарда или ее скарификации [5,6,7,10]. Таким образом, доставка трансплантируемых клеток может быть осуществлена только посредством хирургической (или эндоскопической, катетеризационной) операции. Введение фетальных или иных тканей в вену приведет лишь к «оседанию» единичных клеток и клеточных групп в «чудесной капиллярной сети» легких, а пораженный миокард никогда не получит целебные клетки. Еще менее перспективны в этом смысле подкожные или внутримышечные введения. Таким образом, клеточная трансплантация – хирургический метод лечения и противопоставлять ее любой иной операции на сердце, как это сделано в анализируемой статье, нелепо. Допущение возможности получения эффекта от простого введения тканей в вену означает наивную веру авторов в волшебное превращение фетальной, стволовой клетки в кардиомиоцит или другие клетки, а именно это и не подтверждают международные исследования [1,8].
Выбор авторами в качестве патологии для оценки эффективности фетальной трансплантации ишемической болезни сердца (ИБС) в виде коронарной недостаточности также вызывает недоумение. Данные формы ИБС являются главными объектами работы кардиохирургов и интервенционных кардиологов (рентгенангиохирургов) во всем мире. Челябинск – не исключение в этом смысле, поскольку в трех больницах города выполняются операции по поводу ИБС. Результаты аортокоронарного шунтирования и стентирования положительны у большинства больных и не требуется изобретения «колеса» для того, чтобы улучшить положение дел у данной категории больных. Но проблема советской, а теперь российской кардиологии, а Челябинск – не исключение и в этом смысле, заключается в том, что терапевт-кардиолог позиционируется как медицинский профессионал, имеющий самостоятельное, изолированное от кардиохирурга или интервенционного кардиолога значение в лечении неосложненных форм ИБС. Ему трудно полноценно оценить прогностические данные коронарографии, что обусловливает низкий интерес кардиолога к этому виду исследования. Мысля не анатомически, он полагает возможным лечение больного консервативными средствами, лазерами, скэнерами, биосканами etc., а теперь и «трансплантацией фетальных тканей» по самобытной методике, наравне с хирургией. В кардиологическом сообществе популярны диковинные взгляды о том, что аортокоронарное шунтирование не продляет жизнь пациентов и не предупреждает возникновение инфаркта миокарда, а лишь улучшает качество жизни. Описанное положение привело к пропасти между нашей страной и странами Западной Европы и Северной Америки по продолжительности жизни, которая в России на 14 лет короче, а также отразилось на значении ИБС в структуре смертности населения. И, конечно, данное положение катастрофически влияет на количество выполняемых операций. Если в США производится 539000 стентирований коронарных артерий и 553000 операций аортокоронарного шунтирования в год [8], то в России, при ненамного меньшем населении, выполняется около 10000 данных процедур, т.е. отставание имеет стократный характер (!). Мало того, кардиологи затягивают безрезультатные попытки консервативного лечения неосложненных форм ИБС, в результате чего на операцию направляются пациенты, шестьдесят процентов из которых уже перенесли значимый инфаркт миокарда, а почти пятнадцать процентов – имеют огромные аневризмы левого желудочка. Количество последних растет год от года (см.табл. по данным ООО Центр хирургии сердца).
Если же вернуться к вопросу о выборе патологии для оценки эффективности клеточной трансплантации, то наиболее подходящей для этого категорией больных являются пациенты с кардиомиопатией. Эта патология трудно поддается и консервативной, и хирургической коррекции, что оправдывает любые действия, направленные на помощь этим больным. Кроме того, состояние пациентов и полученные от оценки их гемодинамики данные являются наиболее чувствительными тестами для определения эффективности клеточной трансплантации. Но и здесь существуют проблемы связанные с клиническим использованием клеток костного мозга и, особенно, миобластов из-за выраженного аритмогенного эффекта от их интрамиокардиального введения. В работе Smits PC, van Geuns RJ, Poldermans D et al.[9] из пяти больных, которым было введены аутомиобласты, одному больному пришлось имплантировать кардиовертер-дефибриллятор в связи с возникновением пароксизмов желудочковой тахикардии и фибрилляции. По мнению R.Makkar, M.Lill b
Наконец, касаясь последнего вопроса о критериях оценки положительной эффективности «трансплантации фетальных тканей», совершенно непонятными являются такие показатели, как уровень артериального давления, количество и качество холестерина, биохимические показатели и наиболее непонятный критерий – качество жизни. В целом, не ясно, на каком теоретическом основании авторы методики связывают перечисленные параметры с введением «фетальных тканей». Допуская возможность влияния «трансплантации фетальных тканей» на уровень артериального давления или холестерина, а также на «качество жизни», авторы метода приближаются к признанию реальности существования народно-сказочных «молодильных яблочек» и булгаковских «яичников обезьяны». Неоднократно предупреждая читателя о недопустимости спекуляций в вопросах клеточной трансплантации, они занимаются именно этим, спекулируя данными, почти наверняка не относящимися к эффектам клеточной трансплантации.
В заключение, необходимо констатировать, что «новый метод лечения ишемической болезни сердца», внедренный «челябинскими кардиологами», это еще один шаг на пути создания сонмища самобытных, оригинальных, далеких от данных мировой науки методов, которыми кишит наша современная действительность, методов, уводящих российскую медицинскую науку и практику в тупик лженауки, непрофессионализма и изоляции.
Ссылки.